ELISA法是20世紀70年代初由荷蘭學者VanWeeman和Schurrs與瑞典學者Engvall和Perlman幾乎同時提出的。最初,ELISA主要用于病毒、細菌的檢測。20世紀70年代末,開始廣泛應用于抗原、抗體的定性和定量測定,包括一些藥物、激素、毒素等半抗原分子的定量檢測。由于ELISA檢測對儀器要求程度低,操作簡便,特別是對樣品前處理要求簡單,易于推廣,且具有準確、靈敏、快速、特異、經濟等優點,日益成為許多領域分析技術研究的重點。
ELISA原理
酶聯免疫吸附測定(ELISA)是一種基于抗原抗體特異性反應的常用免疫學檢測方法。其核心原理是將抗原或抗體結合到固相載體上,并利用酶標記的抗原或抗體進行檢測。固相載體上的抗原或抗體保留其免疫活性,而酶標記的抗原或抗體則同時保留免疫活性和酶的活性。
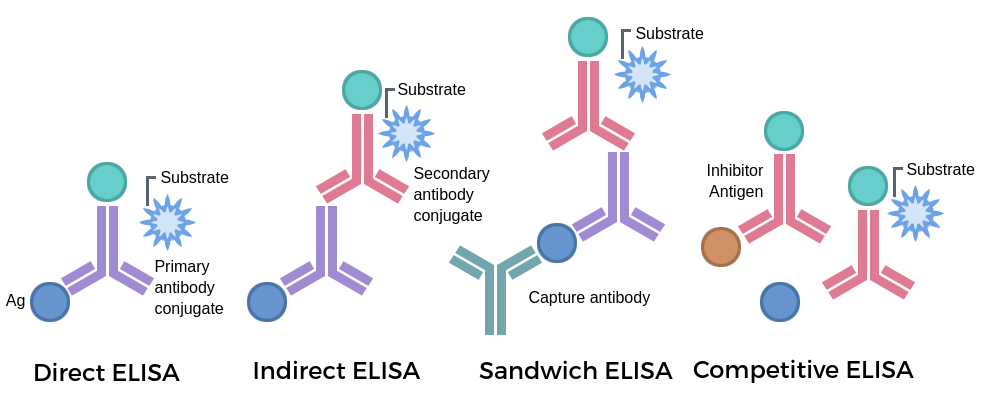
ELISA有多種類型,包括夾心法、競爭法和間接法等,各有不同的操作步驟。以夾心法為例,首先將特異性抗體包被于固相載體,然后加入待測樣品,使其中的抗原與包被抗體結合。洗滌去除未結合的物質后,加入酶標記的二抗,該二抗與結合在固相載體上的抗原特異性結合。再次洗滌去除未結合的酶標記二抗后,加入相應的酶底物。底物在酶的催化下發生反應,生成可檢測的有色產物。產物的量與待測抗原的量成正比。通過酶標儀測定反應產物的吸光度值,并與預先建立的標準曲線進行比較,即可定量測定樣品中待測抗原的濃度。
其他類型的ELISA,例如競爭法和間接法,則采用不同的策略,但都利用了抗原抗體反應的特異性和酶的催化放大作用,實現對目標物質的定性或定量檢測。由于酶的高催化效率,ELISA具有很高的靈敏度。
ELISA實驗技巧
加樣
ELISA實驗中,加樣是至關重要的操作步驟,貫穿于整個實驗過程,包括加樣品、加試劑、加洗滌液等。準確和一致的加樣是保證實驗結果可靠性的關鍵。
目前ELISA實驗中主要使用多道移液器進行加樣,可以同時給多個孔加樣,提高效率并保證加樣一致性。對于少量樣品或標準品,可以使用單道移液器。選擇合適的移液器規格至關重要,以確保加樣體積的準確性。
正確的加樣手法如下:將移液器槍頭貼近孔底,但不要接觸孔底,緩慢且平穩地排出液體,避免產生氣泡。加樣后稍微抬起槍頭,再離開孔,以免吸回液體。避免將液體加到孔壁上,并確保所有試劑都加到孔底。每次加樣后,應更換槍頭,防止交叉污染。
洗滌步驟也需要正確的加樣操作。使用洗滌液沖洗整個孔壁,并保證足夠的浸泡時間,以充分去除未結合的物質。
在加樣前,需要充分混勻試劑,確保試劑濃度均勻。某些步驟之后,例如加酶標記物后,需要輕輕拍打酶標板,以促進反應。
顯色步驟對時間的要求較高。使用多道移液器可以快速完成加液過程,盡量減少不同孔之間加樣時間的差異。更重要的是,要確保所有孔的反應起始時間一致,以減少誤差。
稀釋
ELISA實驗中,包被抗原、樣本、抗體、酶標二抗等通常需要進行稀釋。準確的稀釋對實驗結果的可靠性至關重要。
稀釋倍數的確定需要根據具體的實驗要求、試劑盒說明書以及樣本的濃度來確定。通常需要進行預實驗,以找到最佳的稀釋倍數。
稀釋時,應使用經過校準的移液器,并根據所需的體積選擇合適的規格。將需要稀釋的物質(如樣本、抗體等)加入到裝有適量稀釋液的試管或EP管中,而不是先加稀釋液到板孔中。使用移液器反復吹打或渦旋振蕩器使樣本與稀釋液充分混勻。對于需要進行系列稀釋的情況,應該采用逐步稀釋的方法,以減少誤差。例如,如果需要將樣本稀釋100倍,可以先稀釋10倍,再從10倍稀釋液中取一部分稀釋10倍,最終達到100倍稀釋。
在整個稀釋過程中,應注意避免交叉污染。例如,每次吸取不同濃度的溶液時,都應更換移液器槍頭。此外,還應根據試劑盒說明書選擇合適的稀釋液。
洗滌
在ELISA過程中,洗滌步驟雖然不直接參與反應,但對實驗結果的準確性和可靠性至關重要。洗滌的目的是去除未與固相抗原或抗體結合的游離酶標記物,以及非特異性吸附于固相載體的干擾物質。聚苯乙烯等塑料材料對蛋白質具有非特異性吸附作用,這些吸附的干擾物質必須通過洗滌步驟去除。
洗滌操作必須嚴格按照試劑盒說明書的要求進行。通常情況下,洗滌步驟需要重復多次,一般為3-5次。每次洗滌時,應確保洗滌液充滿每個孔,并浸泡一定時間,通常為30秒到1分鐘。然后將酶標板倒扣在干凈、無塵的吸水紙上,輕拍板底,吸干孔內殘留的洗滌液,避免用力過猛導致孔內物質濺出。殘留的洗滌液會稀釋后續加入的試劑,影響最終結果的準確性。
常用的洗滌方法包括:手動浸泡式洗滌、流水沖洗式洗滌和自動洗板機洗滌。無論采用哪種方法,都應確保洗滌充分且一致。洗滌液的配制也應嚴格按照試劑盒說明書的要求進行,并使用新鮮配制的洗滌液。
正確的洗滌操作可以最大限度地減少背景信號,提高信噪比,從而保證ELISA結果的準確性和可靠性。
顯色
顯色是ELISA的最后一步,通過酶催化底物生成有色產物來實現信號檢測。不同的酶需要使用不同的底物,例如辣根過氧化物酶(HRP)常用的底物有TMB、OPD等,堿性磷酸酶(AP)常用的底物有PNPP等。
反應溫度和時間是影響顯色的重要因素。在一定范圍內,升高溫度可以加快顯色速度。然而,溫度過高或時間過長都可能導致非特異性顯色或底物耗盡,影響結果的準確性。因此,需要根據具體的試劑盒和實驗條件優化反應溫度和時間,以獲得最佳的信噪比。
定量ELISA中,為了確保結果的準確性,需要在規定的時間點加入終止液來終止酶促反應。然后使用酶標儀在特定波長下讀取吸光度值。
定性ELISA的顯色通常在室溫下進行。雖然時間不必像定量ELISA那樣嚴格控制,但也需要根據陽性對照孔和陰性對照孔的顯色情況,以及預先設定的判斷標準來判斷結果。例如,陽性孔的吸光度值應達到陰性孔吸光度值的特定倍數以上,才能判定為陽性。
除了陽性和陰性對照,ELISA實驗還應設置空白對照,用于扣除背景信號,提高檢測的準確性。
比色
ELISA比色前,需要進行一些準備工作,以確保測量結果的準確性。
首先,用干凈、無塵的吸水紙或專用擦拭布輕輕擦拭酶標板底部,去除殘留的液體、指紋和污漬。避免用力擦拭,以免劃傷板底,影響讀數。確保酶標板清潔且干燥。
然后,將酶標板按照正確的方向放入酶標儀的比色架上,確保與酶標儀的光路匹配。
酶標儀應放置在避光環境中,操作室溫度應控制在15~30℃。使用前,應根據酶標儀的型號和使用環境,預熱酶標儀至指定時間,以使結果更加穩定。并根據需要對酶標儀進行校準,包括定期校準和空白校準。
最后,根據所用底物選擇正確的檢測波長,并根據實驗需求選擇合適的讀數模式(例如:單波長、雙波長等)。設置好參數后,即可開始讀取吸光度值。
上述是ELISA的基本原理及技巧。從抗原抗體的特異性結合到酶催化底物顯色,每一個步驟都環環相扣,影響著最終結果的準確性。只有深入理解ELISA的原理,并嚴格按照操作規范進行實驗,才能獲得可靠的實驗數據。










